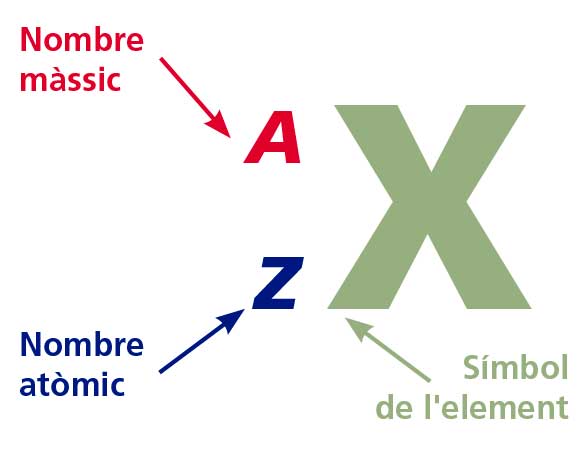
La radioactivitat és el procés que experimenten alguns nuclis
atòmics que els porta a emetre radiació. S'anomenen isòtops radioactius els
que emeten aquesta radiació.
Els nuclis dels isòtops es desintegren emetent
radiació alfa, beta o gamma.
Els isòtops radioactius tenen
diferents aplicacions:
Ø APLICACIÓ COM A FONT D'ENERGIA.
Centrals nuclears amb U-235 i Pu239
Piles de molt llarga durada alimentades per Pu-238
Ø APLICACIÓ EN INVESTIGACIONS I EXPERIMENTS CIENTÍFICS
Per determinar l’antiguitat de restes arqueològiques
En investigació s'utilitzen com a marcadors, per a saber en què es
transforma exactament una substància en una reacció química. Aquests estudis
són importants per a conèixer com transcorren les reaccions en els organismes
vius.
En investigacions forenses per detectar residus de
munició o d’arsènic, en enverinaments.
Ø APLICACIÓ MÈDICA.
Com a diagnòstic: com a rastrejador en certs òrgans
En radioteràpia, per combatre les cèl·lules cancerígenes
que es reprodueixen amb gran rapidesa.
Totes les activitats relacionades amb els isòtops radioactius generen residus. També ho són aquells objectes que han estat en contacte amb material radioactiu i que s'han pogut contaminar.
Els residus radioactius són molt perillosos.
Petites quantitats poden emetre radiació perillosa per a la salut humana. I com
són molt duradors continuen emetent radiació durant milers d'anys.
En aquest vídeo podeu escoltar conceptes bàsics sobre l'energia nuclear
En aquest vídeo podeu escoltar conceptes bàsics sobre l'energia nuclear